Un amestec gazos,format din N2 si o substanta elementara,necunoscuta,contine 80% N2(procente de volum) si are densitatea(
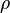 ) 1,405 kg,masurata la 27 grade C si 1,2 atmosfere.Determina:
) 1,405 kg,masurata la 27 grade C si 1,2 atmosfere.Determina:a)masa moleculara a substantei gazoase necunoscute;
b)compozitia amestecului gazos exprimata in procente de masa.
Rezolvare:
__ __
a) P=
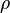 RT/M => M =
RT/M => M = 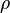 RT/P => M =[0,082 (l*atm)/mol*K *300K *1,405g/103*l ] / 1,2 atm
RT/P => M =[0,082 (l*atm)/mol*K *300K *1,405g/103*l ] / 1,2 atm=[0,082*l*atm*300 K*1,405*103]/ 103 *1,2atm *mol*K*dm3
=28,8025 g/mol
__ ___
M = 80/100 * MN2 +20/100 * Mx => M = 22,4+0,2 Mx => 28,8025=22,4+0,2 Mx =>Mx =32,014=>x=O2
b)
100 l amestec............80 l N2.................20 l O2
V/22,4 = m/M => m= VM/22,4 => 100 g N2
V/22,4=m/M=> m =VM/22,4= 28,57 g O2
1 mol N2............22,4 l N2...................28 g N2
80 l N2......................nN2
nN2 =100g N2
Am(estec)= 100 g N2 + 28,57 g O2
128,57 g Am..........100g N2...................28,57 g O2
100 g Am................x.................................y
x=77,77% N2
y=22,23% O2

e de clasa a 7
RăspundețiȘtergere